ÁCIDOS CARBOXILICOS:
Es una función de carbono primario. Se caracteriza por tener en el mismo carbono el grupo carbonilo y un oxhidrilo. Se nombran anteponiendo la palabra ácido y con el sufijo oico. Algunos de ellos son más conocidos por sus nombres comunes como el ácido fórmico (metanoico) y ácido acético (etanoico).
-Estado natural: Algunos se hallan en las picaduras de los insectos como el metanoico (hormigas), otros en aceites y grasas y los superiores en las ceras.
-Propiedades fisicas:
Los ácidos carboxílicos hierven a temperaturas muy superiores que los alcoholes, cetonas o aldehídos de pesos moleculares semejantes. Los puntos de ebullición de los ácidos carboxílicos son el resultado de la formación de un dímero estable con puentes de hidrógeno..
Puntos de ebullición: Los ácidos carboxílicos que contienen más de ocho átomos de carbono, por lo general son sólidos, a menos que contengan dobles enlaces. La presencia de dobles enlaces (especialmente dobles enlaces cis) en una cadena larga impide la formación de una red cristalina estable, lo que ocasiona un punto de fusion más bajo.
Los puntos de fusión de los ácidos dicarboxílicos son muy altos. Teniendo dos carboxilos por molécula , las fuerzas de los puentes de hidrógeno son especialmente fuertes en estos diácidos: se necesita una alta temperatura para romper la red de puentes de hidrógeno en el cristal y fundir el diácido.
Puntos de fusión: Los ácidos carboxílicos forman puentes de hidrógeno con el agua, y los de peso molecular más pequeño (de hasta cuatro átomos de carbono) son miscibles en agua. A medida que aumenta la longitud de la cadena de carbono disminuye la solubilidad en agua; los ácidos con más de diez átomos de carbono son esencialmente insolubles.
Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman enlaces de hidrógeno con ellos. Además, los alcoholes no son tan polares como el agua, de modo que los ácidos de cadena larga son más solubles en ellos que en agua. La mayor parte de los ácidos carboxílicos son bastante solubles en solventes no polares como el cloroformo porque el ácido continua existiendo en forma dimérica en el solvente no polar. Así, los puentes de hidrógeno de dímero cíclico no se rompen cuando se disuelve el ácido en un solvente polar.
Propiedades químicas:
Aunque los ácidos carboxílicos contienen también al grupo carbonilo, sus reacciones son muy diferentes de las de las cetonas y los aldehídos. Las cetonas y los aldehídos reaccionan normalmente por adición nucleofílica del grupo carbonilo, pero los ácidos carboxílicos y sus derivados reaccionan principalmente por sustitución nucleofílica de acilo, donde un nucleófilo sustituye a otro en el átomo de carbono del acilo (C=O).
Formación de hidrólisis de nitrilos: Los mejores reactivos para convertir los ácidos carboxílicos en cloruros de ácido son el cloruro de tionilo (SOCl2) y el cloruro de oxalilo (COCl)2, porque forman subproductos gaseosos que no contaminan al producto. El cloruro de oxalilo es muy fácil de emplear porque hierve a 62ºC y se evapora de la mezcla de reacción.
Síntesis y empleo de cloruros de ácido:
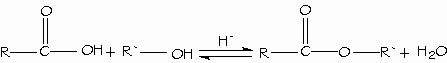
Los ácidos carboxílicos se convierten directamente en ésteres mediante la esterificación de Fischer, al reaccionar con un alcohol con catálisis ácida.
Condensación de los ácidos con los alcoholes. Esterificación de Fischer.
El hidruro de litio y aluminio (LiAlH4) reduce los ácidos carboxílicos para formar alcoholes primarios. El aldehído es un intermediario en esta reacción, pero no se puede ailar porque se reduce con mayor facilidad que el ácido original.
Reducción de los ácidos carboxílicos: Un método general para prepara cetonas es la reacción de un ácido carboxílico con 2 equivalentes de un reactivo de organolitio.
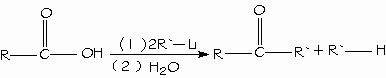
Alquilación de los ácidos carboxílicos para formar cetonas: Descarboxilación de los radicales carboxilato.
Los ácidos carboxílicos se pueden convertir en halogenuros de alquilo con pérdida de un átomo de carbono mediante la reacción de Hunsdiecker.
Usos y aplicaciones en la industria:
Se utilizan los acidos carboxilicos como emulsificantes, se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.Además se usan como antitranspirantes y como neutralizantes, tambien para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
Conocidos como ácidos grasos:
Compuestos:
Nombres y fuentes naturales de los ácidos carboxílicos Estructura Nombre IUPAC Nombre común Fuente natural
-HCOOH Ácido metanoico Ácido fórmico Destilación destructiva de hormigas (formica en latín).
-CH3COOH Ácido etanoico Ácido acético Fermentación del vino.
-CH3CH2COOH Ácido propanoico Ácido propiónico Fermentación de lácteos (pion en griego)
-CH3CH2CH2COOH Ácido butanoico Ácido butírico Mantequilla (butyrum, en latín)
-CH3(CH2)3COOH Ácido pentanoico Ácido valérico Raíz de la valeriana officinalis
-CH3(CH2)4COOH Ácido hexanoico Ácido caproico Dolor de cabeza
En el sistema IUPAC los nombres de los ácidos carboxílicos se forman reemplazando la terminación “o” de los alcanos por “oico”, y anteponiendo la palabra ácido.
El esqueleto de los ácidos alcanoicos se enumera asignando el N° 1 al carbono carboxílico y continuando por la cadena más larga que incluya el grupo COOH
Riesgos y beneficios para la salud:
Los ácidos grasos, la nutrición y las enfermedades cardiovasculares

La alimentación es una fuente importante de ácidos grasos. Esta contribución es vital para mantener un nivel de lípidos estable y para suministrar al cuerpo los ácidos grasos esenciales. Los ácidos grasos calificados de esenciales incluyen los omea-3 y omeha-6 El cuerpo humano no puede sintetizarlos, o los sintetiza en cantidades insuficientes, es necesaria por tanto una contribución mínima y regular por medio de la alimentación.
Actualmente, según la AFSSA, la dieta proporciona suficiente omega-6 y muy poco omega-3, con una relación omega-6/omega 3 insuficiente.
Sin embargo, numerosos estudios han demostrado que el exceso de ácidos grasos (especialmente saturadas e insaturados trans) podría tener consecuencias para la salud, incluido el aumento de forma significativa del riesgo de problemas cardiovasculares. Algunos estudios se centran en el consumo excesivo de grasas insaturadas trans procedentes de los procesos industriales (véase: Comparación de los ácidos grasos (trans) naturales e industriales ) como la hidrogenación parcial de los ácidos grasos de origen vegetal (aceites).
BIBLIOGRAFIA:
http://acidoscarboxilicosporchristiande11a.blogspot.com/p/usos-o-aplicaciones.html
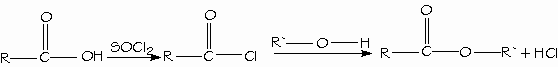
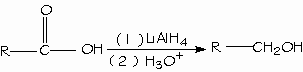
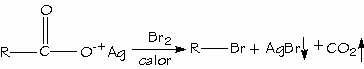











.jpg)








